Geometri molekul adalah susunan tiga dimensi dari atom-atom dari suatu molekul. Geometri molekul mempengaruhi sifat-sifat fisis dan kimianya seperti titik leleh, titik didih, kerapatan dan jenis reaksi yang dialaminya. Terdapat suatu cara sederhana yang dapat memungkinkan kita untuk meramalkan geometri molekul atau ion dengan cukup akurat jika kita mengetahui jumlah elektron di []sekitar atom pusat dalam struktur Lewisnya. Dasar pendekatannya adalah asumsi bahwa pasangan elektron di kulit valensi saling bertolakan satu sama lain. Kulit valensi merupakan kulit terluar yang ditempati elektron dalam suatu atom yang biasanya terlibat dalam ikatan. Dalam ikatan kovalen, sepasang elektron yang sering disebut sebagai pasangan ikatan, berperan dalam mengikat dua atom. Tetapi dalam molekul poliatomik, dimana terdapat dua atau lebih ikatan antara atom pusat dengan atom disekitarnya, pasangan itu berada sejauh mungkin satu sama lain. Oleh karena itu, bentuk yang dipilih oleh suatu molekul berusaha meminimalkan tolakan yang terjadi. Pendekatan untuk kajian ini disebut model Valence-Shell Elektron Pair Repulsion (VSEPR). Pendekatan ini menjelaskan susunan geometrik dari pasangan elektron di sekitar atom pusat sebagai akibat tolak menolak antara pasangan elektron.
Untuk meramalkan molekul dengan menggunakan metode VSEPR ini maka perlu diperhatikan bahwa terdapat 3 jenis gaya tolak dalam molekul- antara pasangan elektron ikatan, antara pasangan elektron bebas, dan antara pasangan elektron ikatan dan pasangan elektron bebas. Secara umum gaya tolak menurun menurut urutan berikut :
Elektron-elektron dalam satu ikatan ditahan oleh gaya tarik inti kedua atom yang berikatan. Elektron-elektron ini mempunyai “distribusi ruang” yang kurang dibandingkan pasangan elektron bebas, yaitu, elektron tersebut menempati ruang yang lebih kecil daripada pasangan elektron bebas, yang hanya terkait dengan satu atom tertentu. Karena pasangan elektron bebas dalam molekul menempati ruang yang lebih besar, pasangan elektron ini mengalami tolakan yang lebih kuat dari pasangan elektron bebas tetanganya dan dari pasangan elektron ikatan. Molekul yang memiliki pasangan elektron bebas lebih sulit diramalkan dibandingkan dengan molekul yang hanya memiliki pasangan elektron ikatan, hal ini dikarenakan kekuatan tolakan pasangan elektron bebas yang besar menyebabkan molekul membentuk sudut dan kemiringan yang lebih sulit diduga.
Untuk mencatat jumlah total pasangan elektron ikatan dan pasangan elektron bebas kita menandai molekul sebagai ABxEy, dengan A sebagai atom pusat, B sebagai jumlah pasangan eletron ikatan yang terbentuk, dan E sebagai jumlah pasangan elektron bebas pada A, sehingga pada molekul yang tidak memiliki pasangan elektron bebas cukup ditulis dengan ABx.
Berikut adalah tabel yang menunjukan bentuk molekul dari tiap-tiap molekul dengan kombinasi jumlah pasangan elektron ikatan dan pasangan elektron bebas tertentu:
 |
| clik to maximize |
Terdapat hubungan antara momen dipol molekul poliatomik dengan geometri molekulnya, dimana kita dapat mengetahui geometri suatu molekul dengan mengetahui jumlah elekgtronnya ditambah dengan pengetahuan akan jumlah momen dipol dari molekul tersebut. Contohnya adalah karbon dioksida (CO2), yang merupakan molekul triatomik. Sebagai molekul triatomik, maka karbon dioksida memiliki kemungkinan bentuk geometri linear atau menekuk.
Pada dua kemungkinan bentuk molekul karbon dioksida, momen dipol keseluruhan dari molekul tersusun atas dua momen ikatan, yaitu momen dipol dalam masing-masing ikatan polar C=O. Momen ikatan adalah suatu besaran vektor yang berarti besaran tersebut memiliki besaran dan arah. Momen dipol yang terukur sama dengan jumlah vektor momen-momen ikatan. Kedua momen ikatan dalam CO2 besarnya sama. Karena arahnya berlawanan dalam molekul CO2 yang linear, jumlahnya sama dengan nol. Di sisi lain jika molekul karbon dioksida menekuk, kedua momen ikatan memiliki jumlah, sehingga molekulnya memiliki momen dipol. Jadi dapat disimpulkan bahwa molekul CO2 adalah linear. Hasil ini sesuai dengan hasil uji bentuk molekul CO2 yang lain.
Nah, sekarang Menentukan Bentuk Geometri Molekul Dengan Teori VSEPR-Studi Kasus Molekul XeF2, dan XeF4
Dengan menggunakan teori VSEPR maka kita dapat meramalkan bentuk geometri suatu molekul. Dalam artikel ini maka akan di contohkan menentukan bentuk geometri molekul XeF2, XeF4, dan XeF6. Diantara molekul-molekul tersebut ada yang memiliki pasangan elektron bebas dan ada yang tidak, jadi molekul-molekul tersebut adalah contoh yang bagus untuk lebih memahami teori VSEPR.
Pertama kita harus mementukan struktur lewis masing-masing molekul. Xe memiliki jumlah elektron valensi 8 sedangkan F elektron valensinya adalah 7.(lihat gambar dibawah)

Struktur Lewis XeF2 seperti gambar sebelah kiri, dua elektron Xe masing-masing diapakai untuk berikatan secara kovalen dengan 2 atom F sehingga meninggalkan 3 pasangan elektron bebas pada atom pusat Xe. Hal yang sama terjadi pada molekul XeF4 dimana 4 elektron Xe dipakai untuk berikatan dengan 4 elektron dari 4 atom F, sehingga meninggalkan 2 pasangan elektron bebas pada atom pusat Xe.


Lihat gambar diatas XeF2 memiliki 2 pasangan elekktron terikat (PET) dan 3 pasangan elektron bebas (PEB) jadi total ada 5 pasangan elektron yang terdapat pada XeF2, hal ini menandakan bahwa geometri molekul atau kerangka dasar molekul XeF2 adalah trigonal bipiramid. Karena terdapat 3 PEB maka PEB ini masing masing akan menempati posisi ekuatorial pada kerangka trigonal bipiramid, sedangkan PET akan menempati posisi aksial yaitu pada bagian atas dan bawah. Posisi inilah posisi yang stabil apabila terdapat atom dengan 2 PET dan 3 PEB sehingga menghasilkan bentuk molekul linear. Jadi bentul molekul XeF2 adalah linier.(lihat gambar dibawah).
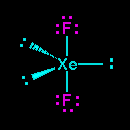

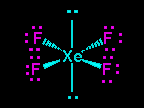
Lihat gambar strutur lewis XeF4 memiliki 4 pasangan elekktron terikat (PET) dan 2 pasangan elektron bebas (PEB) jadi total ada 6 pasangan elektron yang terdapat pada XeF4, hal ini menandakan bahwa geometri molekul atau kerangka dasar molekul XeF4 adalah oktahedral. Karena terdapat 2 PEB maka PEB ini masing masing akan menempati posisi aksial pada kerangka oktahedral, sedangkan PET akan menempati posisi ekuatorial. Posisi inilah posisi yang stabil apabila terdapat atom dengan 4 PET dan 2 PEB sehingga menghasilkan bentuk molekul yang disebut segiempat planar. Jadi bentul molekul XeF2 adalah segiempat planar.(lihat gambar dibawah).


membantu bgt,
ReplyDeletethanks, semoga bermanfaat
DeleteMembantu sekali, terimakasih ya ;)
ReplyDeletebutuh temn
ReplyDelete