Pada awalnya para ilmuwan menemukan bahwa, gas Hidrogen dapat bereaksi dengan gas Oksigen membentuk air. Perbandingan volume gas Hidrogen dan Oksigen dalam reaksi tersebut adalah tetap, yakni 2 : 1.
Kemudian Joseph Gay Lussac seorang ahli kimia Prancis, tahun 1808 melakukan percobaan tentang volume gas-gas dalam reaksi Kimia. Berdasarkan hasil percobaannya, Gay Lussac memberikan kesimpulan sebagai berikut : “ Volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan bulat yang sederhana bila diukur pada suhu dan tekanan yang sama “ Dikenal dengan Hukum Perbandingan/ Penggabungan Volume atau Hukum Gay Lussac (1808)[]
Menurut Gay Lussac 2 volume gas Hidrogen bereaksi dengan 1 volume gas Oksigen membentuk 2 volume uap air. Pada reaksi pembentukan uap air, agar reaksi sempurna, untuk setiap 2 volume gas Hidrogen diperlukan 1 volume gas Oksigen, menghasilkan 2 volume uap air.
“ Semua gas yang direaksikan dengan hasil reaksi, diukur pada suhu dan rekanan yang sama atau (T.P) sama.”
“ Pada suhu dan tekanan yang sama perbandingan volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan bulat “
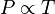
atau
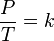 where:
where: P adalah tekanan gas.
T adalah temperatur gas (dalam Kelvin).
k adalah sebuah konstanta.
Hukum ini dapat dibuktikan melalui teori kinetik gas, karena temperatur adalah ukuran rata-rata energi kinetik, dimana jika energi kinetik gas meningkat, maka partikel-partikel gas akan bertumbukan dengan dinding/wadah lebih cepat, sehingga meningkatkan tekanan.Hukum Gay-Lussac dapat dituliskan sebagai perbandingan dua gas
 []
[]
No comments:
Post a Comment